Loạn dưỡng cơ Duchenne là gì?
Bệnh loạn dưỡng cơ Duchenne (DMD) là bệnh dạng loạn dưỡng cơ phổ biến nhất. Đây là một rối loạn di truyền đặc trưng bởi yếu cơ tiến triển và sự thoái hóa của các cơ xương điều khiển hoạt động.
Duchenne ảnh hưởng đến khoảng 1 trong 5.000 trẻ trai còn sống. Người ta ước tính rằng khoảng 20.000 trẻ em được chẩn đoán mắc bệnh Duchenne trên toàn cầu mỗi năm.
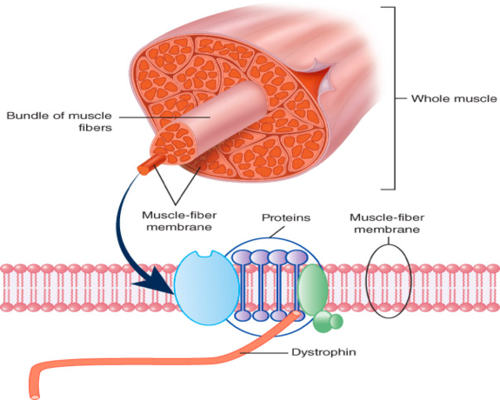
DMD được phân loại là bệnh loạn dưỡng cơ do thiếu hụt một loại protein gọi là dystrophin. Ở Duchenne, đột biến ở gen DMD cản trở quá trình sản xuất protein dystrophin cần thiết để hình thành và duy trì cơ bắp khỏe mạnh. Thiếu các protein dystrophin trong tế bào cơ dẫn đến các tế bào dễ thoái hoá và tổn thương.
Hình 1. Vị trí và vai trò của protein dystrophin trong tế bào cơ
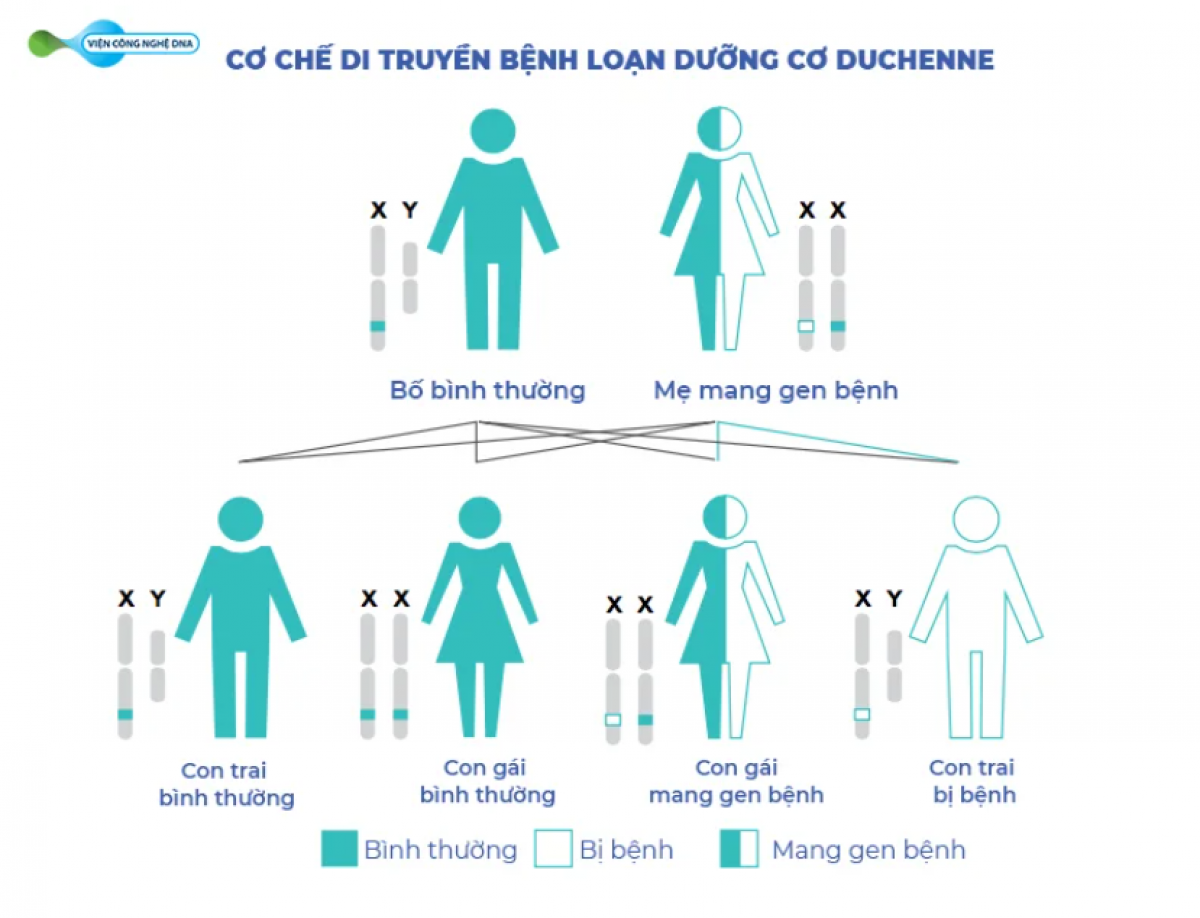
Vì gen DMD nằm trên nhiễm sắc thể X, nên cơ chế di truyền liên quan đến giới tính, bệnh chủ yếu ảnh hưởng đến nam giới, trong khi người nữ thường là người mang gen bệnh. Tuy nhiên, một số phụ nữ có thể biểu hiện mức độ triệu chứng khác nhau của Duchenne và do đó được gọi là người mang gen bệnh biểu hiện. DMD thường được di truyền từ người mẹ; tuy nhiên, trong khoảng 30% trường hợp, bệnh xảy ra tự phát ở người không có tiền sử gia đình mắc bệnh DMD.
Hình 2. Cơ chế di truyền bệnh loạn dưỡng cơ Duchenne
Triệu chứng và chẩn đoán DMD như thế nào?
Hầu hết các bé trai mắc chứng loạn dưỡng cơ Duchenne không được chẩn đoán cho đến khi bệnh bắt đầu biểu hiện triệu chứng, trừ khi có người khác trong gia đình mắc bệnh này thì bệnh mới được chú ý sớm.
Những dấu hiệu đầu tiên của chứng loạn dưỡng cơ Duchenne thường xuất hiện ở độ tuổi từ 1-3 tuổi và thường bao gồm các vấn đề về chức năng cơ. Trẻ trai có thể bắt đầu biết đi muộn hơn các bạn cùng lứa, có thể bị ngã thường xuyên hơn hoặc gặp khó khăn khi chạy, nhảy hoặc đứng dậy khỏi sàn. Trẻ có thể có cơ bắp chân to ra. Một số bé trai mắc loạn dưỡng cơ Duchenne bị chậm nói và đây có thể dấu hiệu đầu tiên của tình trạng này.
Trong giai đoạn nặng, bệnh nhân trở nên tàn phế, mất khả năng đi lại ở độ tuổi 10-12 và phụ thuộc xe lăn. Một khi bệnh nhân phải ngồi xe lăn, một số biến chứng đi kèm sẽ tiến triển nhanh hơn bao gồm chứng vẹo cột sống và co rút cơ. Và ngay cả khi được chăm sóc y tế tối ưu, hầu hết bệnh nhân mắc DMD đều tử vong trong độ tuổi từ 20 đến 40 do biến chứng suy tim và/hoặc suy hô hấp với tuổi thọ trung bình chỉ là 28 tuổi.
Hình 3. Dấu hiệu Gower
(Nguồn: https://www.parentprojectmd.org/about-duchenne/is-it-duchenne/signs-and-symptoms/)
Các xét nghiệm:
Xét nghiệm máu cho thấy nồng độ creatine kinase tăng cao (CK), thường tăng cao trên 20 lần so với trị số bình thường. CK thường được tìm thấy trong cơ nhưng khi cơ bị tổn thương, chẳng hạn như ở Duchenne loạn dưỡng cơ, nó rò rỉ vào máu. Các chỉ số men gan (aminotransferase, ALT và AST) cũng thường cao, hậu quả của tổn thương cơ chứ không phải vấn đề về gan.
Sinh thiết cơ
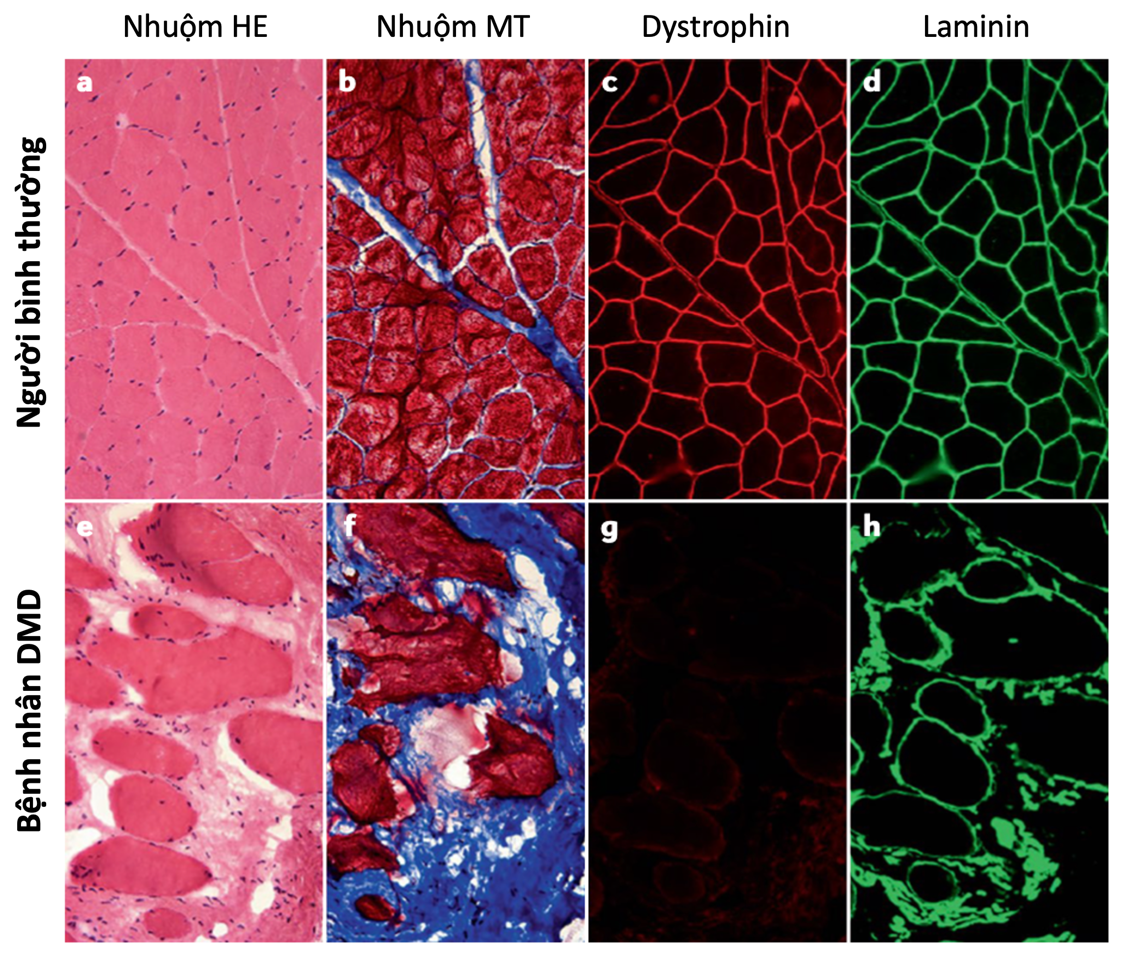
Quá trình lấy một mẫu nhỏ cơ để phân tích, cung cấp thông tin về số lượng protein dystrophin có trong tế bào cơ. Trong một số trường hợp, những xét nghiệm này cũng có thể giúp phân biệt giữa bệnh loạn dưỡng cơ Duchenne và bệnh loạn dưỡng cơ Becker- một dạng bệnh nhẹ hơn. Tuy nhiên, các dấu hiệu lâm sàng và xét nghiệm di truyền thường có thể phân biệt giữa hai dạng mà không cần sinh thiết cơ.
Hình 4. Kết quả sinh thiết cơ ở người bình thường và bệnh nhân DMD
Xét nghiệm di truyền
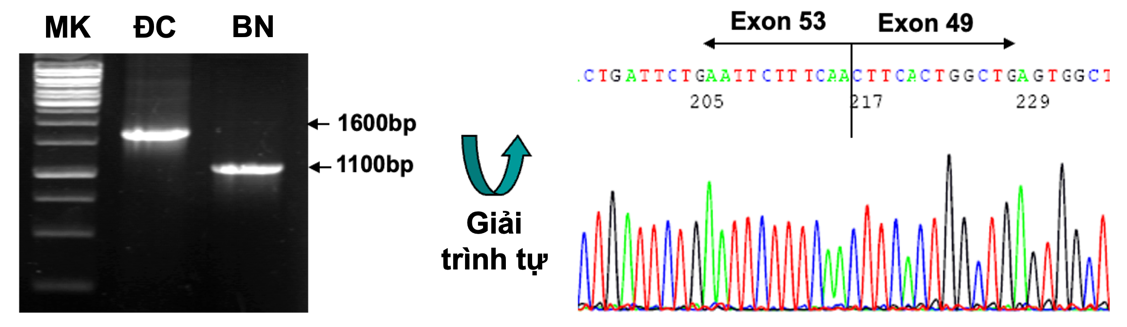
Chứng loạn dưỡng cơ Duchenne phải được chẩn đoán bằng xét nghiệm di truyền. Kết quả cho phép các gia đình đưa ra quyết định về chẩn đoán trước sinh ở lần mang thai tiếp theo và sàng lọc nguy cơ mang gen cho các thành viên khác trong gia đình. Hơn nữa, chẩn đoán di truyền sẽ hỗ trợ xác định xem trẻ có đủ điều kiện tham gia một số thử nghiệm lâm sàng hiện đang được thực hiện.
Hình 5. Kỹ thuật RT-PCR xác định bệnh nhân có đột biến mất đoạn exon 46-50 gen dystrophin.
Điều trị
Vật lý trị liệu
Thông qua tập thể dục giúp phục hồi và duy trì sức cơ và chức năng, giúp duy trì phạm vi hoạt động
Corticosteroid (như prednisone):
Thường được được sử dụng để giúp bảo tồn sức mạnh và chức năng cơ, để ngăn ngừa chứng vẹo cột sống và kéo dài thời gian bệnh nhân có thể đi bộ. Tuy nhiên, corticosteroid cũng gây ra tác dụng phụ không mong muốn như tăng sự thèm ăn, tăng cân, mất khối lượng xương và đục thủy tinh thể.
Liệu pháp gen
Hiện tại, nhiều phương pháp điều trị mới đang được các Trung tâm trên thế giới nghiên cứu và triển khai, nhiều phương pháp trong số này đã được chuyển sang giai đoạn thử nghiệm lâm sàng. Một số liệu pháp gen chính hiện đang được nghiên cứu bao gồm: i) Liệu pháp gây xoá đoạn exon của gen dystrophin; ii) Liệu pháp chuyển vector AAV mang gen microdystrophin; iii) Liệu pháp sử dụng các thuốc có hoạt tính readthrough; iv) Liệu pháp chỉnh sửa gen CRISPR/Cas9 và v) Các liệu pháp tế bào gốc.
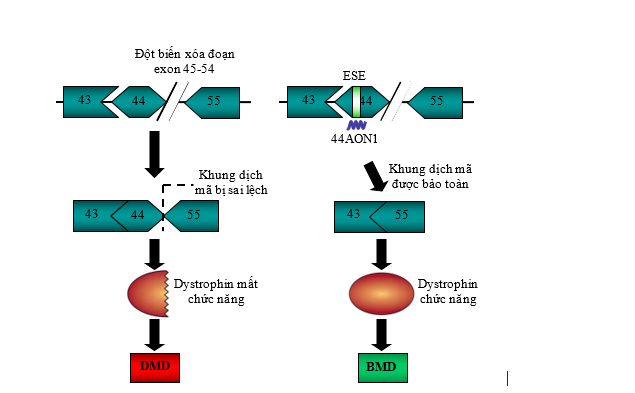
Liệu pháp gây xoá đoạn exon là liệu pháp duy nhất được FDA chấp thuận điều trị trên lâm sàng cho đến nay. Ở bệnh nhân DMD có đột biến gen dystrophin, protein dystrophin không có chức năng sẽ được sản xuất do gián đoạn gen; tuy nhiên, ở một số bệnh nhân, gen có thể được khôi phục một phần (bảo toàn khung dịch mã) để tạo ra protein dystrophin vẫn còn chức năng nhưng không đầy đủ, từ đó có thể làm giảm triệu chứng nghiêm trọng ở bệnh nhân, chuyển từ thể nặng sang thể nhẹ hơn. Liệu pháp điều trị này phụ thuộc vào dạng đột biến của mỗi bệnh nhân. Cho tới thời điểm hiện tại, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã chấp thuận có điều kiện 4 loại thuốc kể từ 2016 bao gồm: eteplirsen (Sarepta, xoá exon 51), viltolarsen (NS pharma, xoá exon 53), golodirsen (Sarepta, xoá exon 53) và casimersen (Sarepta, xoá exon 45).
Hình 6. Mô hình liệu pháp sử dụng AON gây xóa exon khôi phục lại khung dịch mã
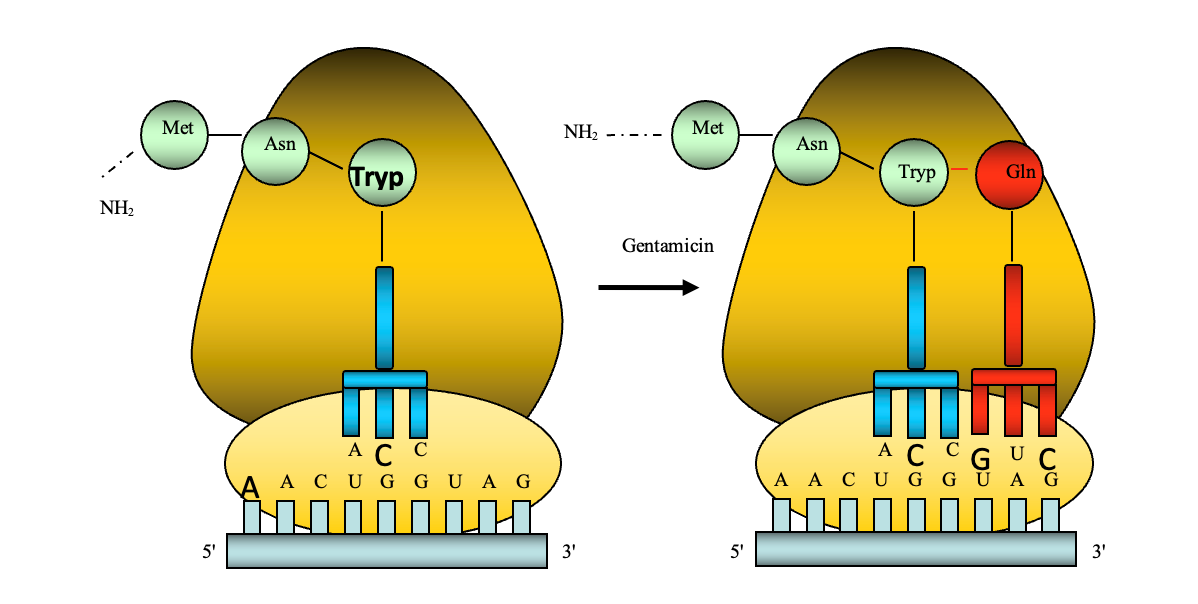
Một hướng nghiên cứu khác đang thu hút nhiều sự quan tâm các nhà khoa học trên thế giới là việc thử nghiệm các loại thuốc có khả năng can thiệp trực tiếp vào quá trình dịch mã protein chức năng. Hướng nghiên cứu này được khởi nguồn từ một phát hiện mới về hoạt tính của gentamicin (kháng sinh quen thuộc trong điều trị nhiễm khuẩn) giúp hồi phục quá trình tổng hợp protein dystrophin ở bệnh nhân DMD.
Hình 7. Gentamicin giúp bộ máy dịch mã của tế bào vượt qua mã dừng đột biến bằng việc sử dụng acid amin glutamin cho mã dừng UAG
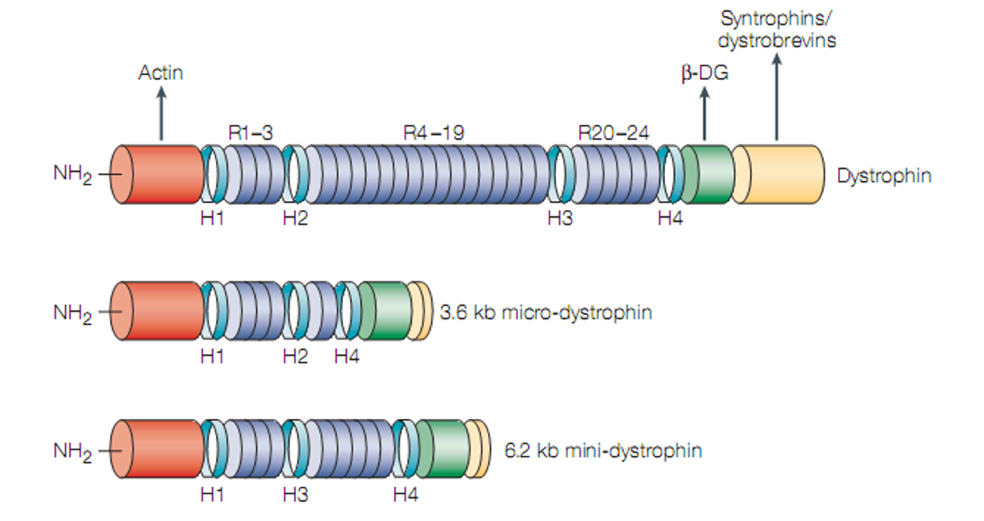
Liệu pháp chuyển vector AAV mang gen microdystrophin với hy vọng trở thành một liệu pháp điều trị tổng thể cho mọi dạng đột biến tuy nhiên gặp nhiều thách thức do kích thước khổng lồ của gen dystrophin. Các nhà nghiên cứu đã thiết kế ra gen minidystrophin và microdystrophin có kích thước nhỏ hơn nhiều so với gen dystrophin mà không làm ảnh hưởng đến chức năng tổng hợp của protein dystrophin. Một số thử nghiệm lâm sàng về chuyển dystrophin qua trung gian AAV đã được thực hiện ở nhiều trung tâm trên thế giới trong vài thập kỷ qua. Tuy nhiên, vẫn còn những thách thức liên quan đến hiệu quả, các phản ứng miễn dịch, các yếu tố bao gồm tuổi của bệnh nhân, AAV cassette promoter, AAV serotypes, liều lượng và phương pháp chuyển gen đều phải được đánh giá cẩn thận.
Hình 8. Cấu trúc phân tử mRNA dystrophin trưởng thành và các mô hình micro và mini dystrophin
Tại Việt Nam hiện nay không có phương pháp điều trị khỏi hoàn toàn bệnh DMD, chỉ dùng thuốc và liệu pháp phục hồi chức năng có thể giúp giảm nhẹ một số các triệu chứng và có khả năng làm chậm quá trình tiến triển của bệnh. Tuy nhiên, một số thử nghiệm lâm sàng liên quan đến điều trị liệu pháp gen ở người bệnh DMD đã chuẩn bị được tiến hành tại Việt Nam. Dự kiến đến cuối năm 2024, Vesleteplirsen (một loại thuốc có tác dụng exon 51 skipping) sẽ được tài trợ bởi Sarepta Therapeutic, Inc và dự kiến sẽ tuyển 160 trẻ, phủ 37 điểm nghiên cứu, yêu cầu trẻ trong độ tuổi 6-15 tuổi và vẫn còn khả năng đi lại được.
GS.BS. Trần Vân Khánh
Giám đốc Trung tâm nghiên cứu Gen-Protein -Trường Đại học Y Hà Nội
Giám đốc chuyên môn Viện Công nghệ DNA